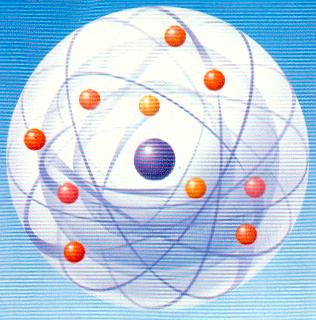
Bohr prouva que l'atome de Rutherford n'était pas valable :
-
Un corps porteur d'une charge électrique,
lorsqu'il est accéléré,
émet un rayonnement lumineux
(d'après les théories de Maxwell).
-
Or c'est le cas de l'électron : son orbite
autour du noyau le soumet à
une accélération incessante.
-
Il devrait donc libérer de la lumière
(c'est à dire de l'énergie).
-
S'il perdait de l'énergie, l'électron finirait
par s'écraser sur le noyau.
Il rassemble alors toutes les connaissances de l'époque
sur les atomes et émet quelques hypothèses.
En 1913, il a fini de mettre au point son modèle de l'atome :
-
Les électrons n'ont pas un nombre infini de possibilités
d'orbites circulaires mais seulement quelques-unes, fixes,
toujours les mêmes.
-
Dans ces états dits stationnaires, les électrons
n'émettent pas de lumière.
-
Quand ils reçoivent une certaine quantité
d'énergie, ils quittent leur orbite pour une orbite
supérieure et inversement quand ils perdent de l'énergie..
Les collisions avec le noyau sont donc impossibles !!...
 précédent
précédent
 suivant
suivant


